
“美国 GRAS(Generally Recognized as Safe,一般公认安全)是美国食品监管体系中针对食品成分安全性设立的一项法定豁免机制,适用于在既定使用条件下被科学界普遍认为安全的物质。符合GRAS条件的物质可不再按照食品添加剂的审批程序接受上市前许可。”

根据认定路径的不同,GRAS通常分为两类:自我声明GRAS(self-affirmed GRAS)和向美国食品药品监督管理局(FDA)通报的GRAS(以下简称FDA GRAS)。
与self-affirmed GRAS由企业自行组织专家评估并承担合规责任不同,FDA GRAS需要申请人向FDA提交完整的GRAS通报材料,由FDA对物质的安全性基础、预期用途及相关科学证据进行审查,并就该通报作出书面回应。若FDA的答复为“FDA has no questions”(FDA无异议),则表明FDA未对该物质在所述使用条件下作为GRAS物质提出异议。
本文将重点梳理和分析2025年度美国FDA GRAS的更新情况,以期为相关企业的合规申报和产品布局提供参考。文中统计数据均基于FDA官网截至2025年12月30日公布的GRAS更新信息。
01.
2025年FDA GRAS更新情况汇总
目前,美国FDA针对GRAS 通报(GRAS Notice)在完成审查后,通常会给出以下四种答复状态:
1️⃣FDA has no questions(FDA无异议):表示FDA在审查申请人提交的资料后,未就该物质在所述使用条件下作为GRAS物质提出异议。
2️⃣Pending(等待中/在审状态):指GRAS通报已被FDA接收,但尚处于审查过程中,尚未形成最终答复。
3️⃣At the notifier’s request, FDA ceased to evaluate this notice(应通知人要求,FDA停止对该通报的评估):指申请人主动撤回或请求终止该GRAS通报的审查,FDA 据此停止后续评估。
4️⃣Notice does not provide a basis for a GRAS determination(该通报不足以构成GRAS认定的基础):表示FDA认为所提交的资料无法支持该物质在既定使用条件下被认定为GRAS。
在2025年的GRAS更新中,FDA的部分答复在表述上出现了更为细化的情况。例如,在GRN 1236中,FDA的答复为“FDA has no questions, some uses may require a color additive listing”,即在未对GRAS结论提出异议的同时,提示部分用途可能涉及着色剂法规要求。为便于统计和分析,本文仍将此类情形统一归入“FDA has no questions(FDA无异议)”类别。
根据 FDA 官网公布的更新信息统计,2025 年共有90款物质发生GRAS 状态更新,其中:
🟠FDA has no questions(FDA无异议):57款
🟠Pending(在审/等待中):24款
🟠At the notifier’s request, FDA ceased to evaluate this notice(应通知人要求停止评估):7款
🟠Notice does not provide a basis for a GRAS determination(该通报不足以构成GRAS认定的基础):2款
其中57款(约63%)拿到“FDA has no questions”,仅7款由企业主动撤回,2款未通过,说明美国对FDA GRAS合规申报仍保持“高门槛”“高通过率”特征。
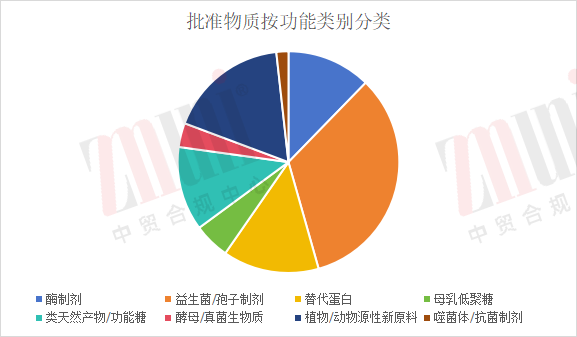
批准物质按功能类别分类,主要可分为以下几类:
1️⃣酶制剂(Enzymes)7个
✔️凝乳酶、三酰甘油脂肪酶、脂肪酶、果聚糖酶、葡萄糖基转移酶等;
2️⃣益生菌/孢子制剂(Probiotics &Spores)19个
✔️以 Lacticaseibacillus、Lactiplantibacillus、Bacillus、Bifidobacterium 为主;
3️⃣替代蛋白(Alternative Proteins)8个
✔️β-乳球蛋白、牛乳铁蛋白、巴西甜蛋白、卵清蛋白、真菌蛋白等;
4️⃣母乳低聚糖HMOs 3个
5️⃣类天然产物/功能糖(Natural Products& Functional Sugars) 7个
✔️肌醇、短链低聚果糖、瑞鲍迪苷、香兰素等
6️⃣酵母/真菌生物质(Yeast/Fungal Biomass) 2个
7️⃣植物/动物源性新原料(Botanical& Animal Novel Foods)10个
✔️樱花蒸馏液/提取物、山椒蒸馏液/提取物、橙皮提取物、低矿羊乳清蛋白粉、液态全羊奶、山羊乳糖等。
8️⃣噬菌体/抗菌制剂(Phage &Antimicrobial)1个
如您需要2025年获批FDA GRAS的物质详细清单,欢迎您联系小助手。
02.
2025年度认证通过的中国企业申报物质
表1 2025年获“FDA has no questions”状态的中国企业申报物质

表2 2025年中国企业新增在审物质
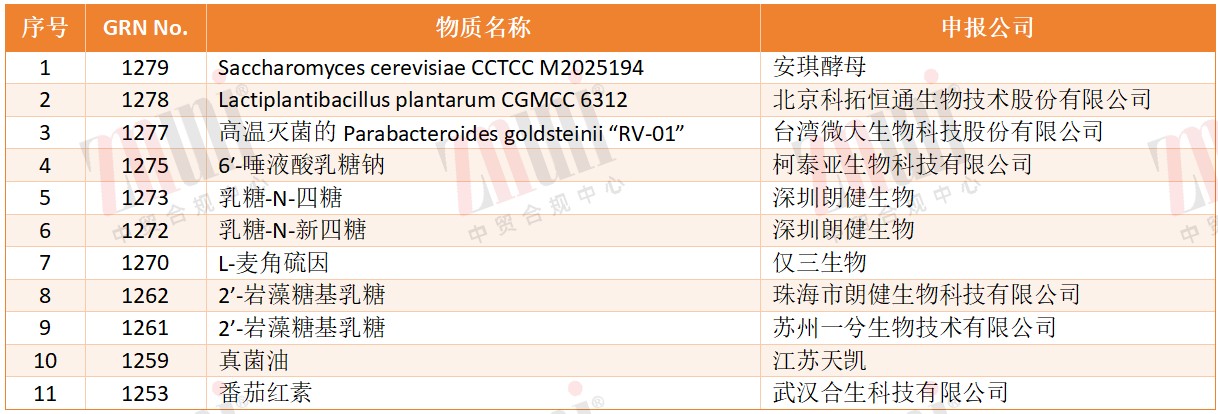
从申报主体看,中国企业在2025年FDA GRAS更新中占据较高比例。90款发生状态更新的物质中,共有31款由中国主体提交,占比约35%。从已披露的数据来看,申报物质绝大多数采用合成生物学路径生产,主要依托微生物底盘制造。
在已获得FDA has no questions(FDA无异议)通知函的物质中,中国企业共有20款。其中,微生物菌种及其制剂8款,母乳低聚糖(HMOs)3款。与此同时,目前由中国企业申报且仍处于FDA在审状态的物质共有11款,其中HMOs达5款,占中国企业在审物质的约45%,已成为当前申报的热门品类。
在中国企业申报热情持续高涨、技术能力不断提升的同时,也需关注美国监管环境的变化。美国国会已提出所谓的《生物技术安全审查法案》,该名称并非指一部已经正式生效的联邦法律,而是部分两党议员陆续提出的一系列立法倡议的统称。相关草案的核心目标,是在美国现有外资安全审查机制基础上,新增针对“生物技术”领域的专项审查要求,其中部分限制性内容已通过2026财年NDAA2026正式落地。
此外,结合美国FDA对self-GRAS监管立场的调整趋势(详见中贸推文🔎《美国GRAS监管新动态:拟取消Self-GRAS的“GRAS”提案》),ZMUni中贸合规中心建议中国企业,如有进入美国市场的中长期战略布局,应尽早规划并启动美国GRAS申报工作,以降低合规不确定性风险。
*注:本次统计参考FDA官网GRAS清单(2025/12/30更新),可能存在数据更新滞后,与最新实际批准(申请企业收到FDA Letter)情况存在差异。
