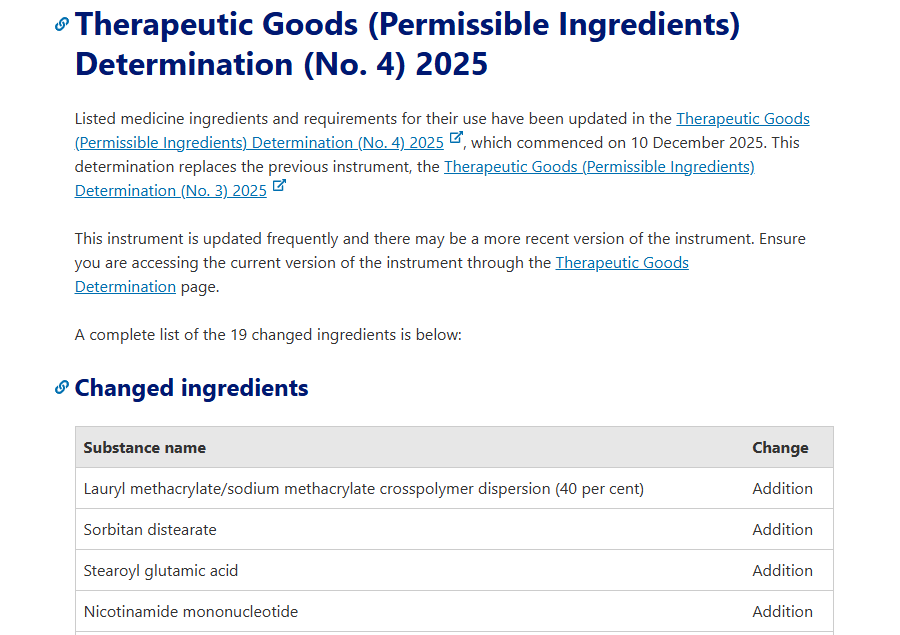
2025年12月10日,澳大利亚医疗用品管理局(TGA)发布最新监管更新,将烟酰胺单核苷酸(NMN)正式纳入“允许在补充药物中使用的成分清单”中(《Therapeutic Goods (Permissible Ingredients) Determination (No. 4) 2025》),标志着NMN在澳大利亚的合规性获得了突破。
关于补充药品:
澳大利亚与我国保健食品定义范畴类似的产品主要是补充药品 (complementary medicines),同时还包括进行适当的健康声称的普通食品,但这些普通食品需要符合《澳大利亚新西兰食品标准法典》中列明的条件及要求。
澳大利亚将特定草药、传统药品、维生素和矿物质、营养补充剂、芳香性植物产品和顺势疗法产品等产品归类为“补充药品”,由澳大利亚卫生部下属的治疗产品管理局(TGA)按照药品进行监管。
中国企业重大突破:
值得注意的是,该NMN原料申办方(sponsor)为中国尚科生物(SyncoZymes)。
TGA公告详情:


以下为TGA公告中部分内容翻译参考:
“在 2027 年 12 月 10 日之前,烟酰胺单核苷酸(nicotinamide mononucleotide)仅可用于符合以下条件的药品中:
(a) SyncoZymes(上海)有限公司(客户编号 83759)为该药品的申办方(主要申办方);或
(b) 其他主体为该药品的申办方(次要申办方),且澳大利亚治疗用品管理局(TGA)已获通知,确认该次要申办方已获得主要申办方授权,可在该药品中使用该成分。
🟠含有烟酰胺单核苷酸的药品,其给药途径必须为口服。
🟠该药品的每日最大推荐剂量不得超过 500 毫克烟酰胺单核苷酸。
🟠含有烟酰胺单核苷酸的药品,其推荐使用期限不得超过 12 周。
🟠含有烟酰胺单核苷酸的药品仅限成人使用,不得用于孕妇或哺乳期妇女。”
