随着生物技术在化妆品领域的广泛应用,发酵来源的新原料因其天然、安全及功效潜力受到广泛关注,其安全性、稳定性及合规性问题也日益成为监管重点。近年来,国家监管部门陆续出台多项技术指导文件,对发酵类化妆品新原料的菌种管理提出了系统化、精细化的要求。
本文结合近年发布的相关法规与技术指导原则,系统梳理发酵类化妆品新原料菌种合规要点。
01
法规依据与核心要求
🔵2021年4月8日,国家药品监督管理局发布《化妆品安全评估技术导则(2021年版)》,生物技术来源的原料,一般包括以下内容:
(1)制备过程;
(2)所用的生物描述:供体生物、受体生物、经修饰的微生物等;
(3)生物技术的类型/方式;
(4)微生物致病性;
(5)毒性成分包括生物代谢物、产生的毒素等;(6)理化特性;
(7)微生物质量控制措施;
(8)防腐剂和/或其他添加剂。
对于特殊生物技术来源的原料,其中经修饰的对象(如微生物)或潜在的毒性物质不能彻底去除的,需提供数据予以说明。
🔵2023年1月19日,中检院发布《化妆品新原料判定研究技术指导原则(征求意见稿)》:
◾发酵工程技术制备的新原料利用发酵工程技术制备的新原料应说明发酵生产菌种属名、种名及菌种号,并提供相应拉丁学名;提供菌种(株)来源,鉴定报告(包括表型特征和基于基因分型的菌株水平的鉴定结果)和菌种(株)的生物学、遗传学、功效学特性,并开展原料稳定性研究。
◾如使用菌种(株)为利用基因工程所获得的“工程菌”,则需要提供载体构建、工程菌(株)等详细信息;如使用菌种(株)为细胞融合等技术进行的发酵,则应提供使用菌株的筛选和稳定性验证、原生质体的制备、融合等详细信息。
◾发酵工程技术制备的新原料的底物应为单一来源,生产菌种原则上为单一菌种,如使用两种菌种以上的,应提供每种菌种的上述资料、多菌种使用的必要性和不同菌种间是否发生影响作用、发酵产物中的质控指标和产生风险物质的验证资料。
🔵2025年9月24日,中检院发布《化妆品新原料注册备案资料技术通则(征求意见稿)》:
生产过程中使用真菌、细菌等微生物的,应当提供所用菌种来源以及安全性、稳定性等相关背景资料。
对于自然筛选获得的菌种,应当由具有相关资质的专业第三方机构进行鉴定;进行基因修饰的,除由具有相关资质的专业第三方机构进行鉴定外,还应说明修饰改造过程,并提供相关安全背景资料。
🔵2025年12月11日,中检院发布《发酵来源化妆品新原料命名技术指导原则(征求意见稿)》:
◾使用特定菌种进行发酵的,注备人应当明确菌种来源,确认所用微生物种属信息,并分析其安全性、稳定性等相关背景资料。对于自然筛选获得的菌种,应当由具有相关资质的专业第三方机构进行鉴定;进行基因修饰的,除菌种鉴定外,还应考虑修饰改造过程对菌种的影响。
◾同时新原料命名时,原料名称考虑由菌种名称、底物信息、后处理形式等三部分组合而成,菌种和底物之间可以斜线“/”连接。在对菌种名称命名时,菌种一般应当具体到属名。如仅使用属名可能产生误导(特别是属内包括致病微生物时),则应当具体到种名,例如,蜂生假丝酵母。考虑到原料名称的简洁性,可仅采用菌种中文名称,无需在原料名称中备注菌种拉丁学名。对于采用自然发酵技术获得的新原料,可在原料名称中省略菌种信息,在原料名称中采用相关术语以体现发酵过程,如某植物果实发酵产物。
02
已备案通过的发酵类原料菌种清单
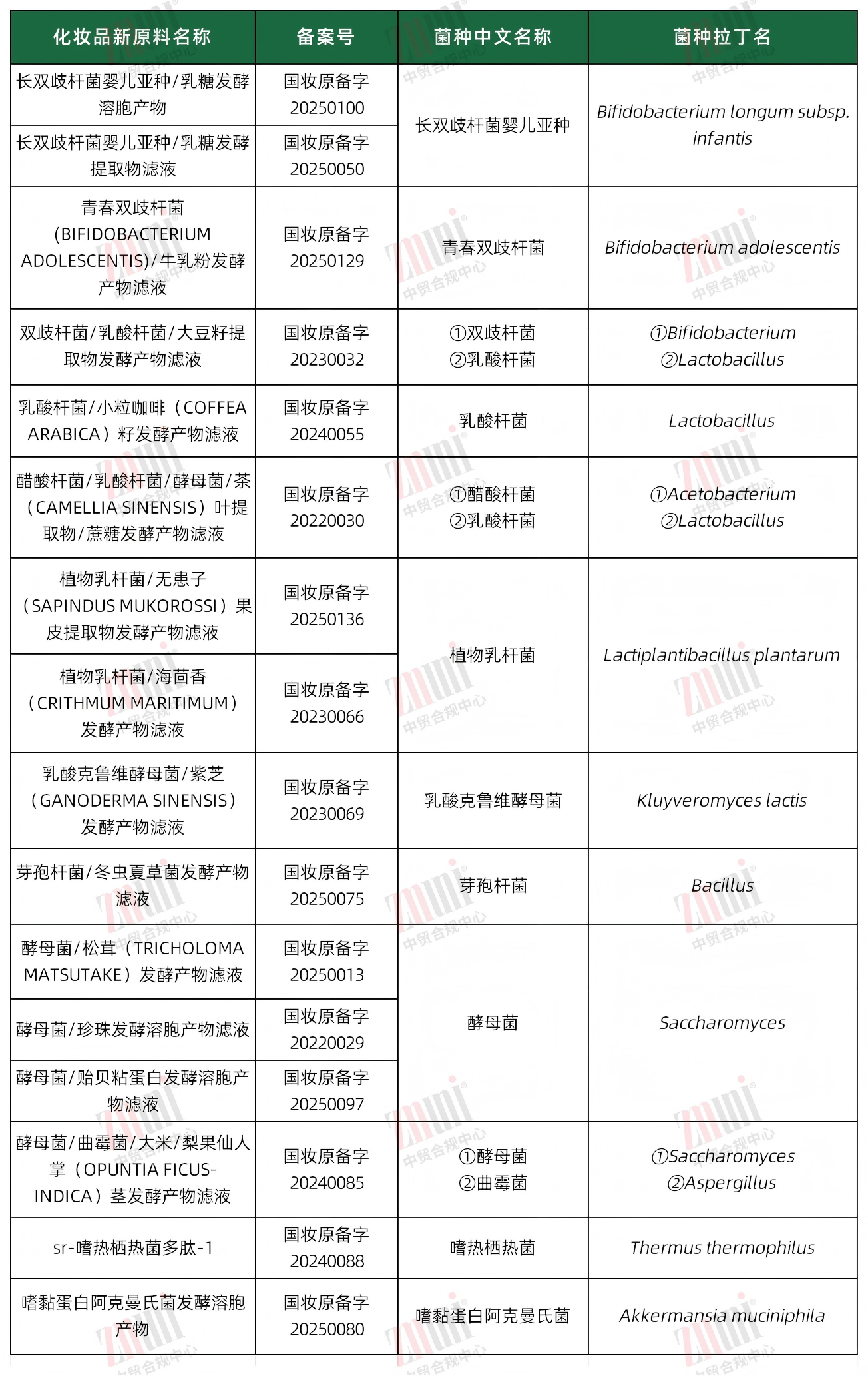
03
写在最后
在当前化妆品新原料监管日趋科学化、精细化的背景下,菌种的合规管理已成为发酵类原料申报的关键环节。未来,随着《化妆品新原料注册备案资料技术通则》《发酵来源化妆品新原料命名技术指导原则》等文件的正式实施,监管部门对菌种信息的完整性、准确性和可追溯性将提出更高要求。企业需从研发源头严格把控菌种选择与管理,建立覆盖全链条的合规体系,实现安全、有效、合法的市场准入。
